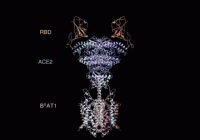北京日报客户端消息,西湖大学周强实验室再次取得重大突破。
北京时间2月21日凌晨,周强研究团队在论文预印本网站BioRxiv再次发文,报道新冠病毒表面S蛋白受体结合结构域与细胞表面受体ACE2全长蛋白的复合物冷冻电镜结构,揭开了新冠病毒入侵人体细胞的神秘面纱。
就在2天前,该团队刚刚在bioRxiv上首次发布了新冠病毒受体ACE2全长结构。
这两篇预印本论文的第一作者为西湖大学生命科学学院博士后鄢仁鸿,通讯作者为西湖大学生命科学学院研究员周强。第一单位和通讯单位均为西湖大学浙江省结构生物学研究重点实验室。这也是西湖大学承担的浙江省“新型冠状病毒肺炎防治应急攻关项目”取得的重要成果,得到浙江省、杭州市相关部门和西湖区的大力支持。

侵入——
病毒“劫持”人体蛋白
ACE2中文名称“血管紧张素转化酶2”。它作为膜蛋白,广泛存在于人体的肺、心脏、肾脏和肠道的细胞中,控制人体血压平衡。S蛋白则存在于冠状病毒的刺突之上。SARS病毒和新冠病毒均属于冠状病毒。
新冠病毒S蛋白有如“强盗”,会“劫持”ACE2作为“人质”。
疫情爆发后,武汉病毒研究所的科学家发现,新冠病毒和SARS病毒一样,也是通过识别ACE2进入人体细胞的。ACE2作为病毒的受体,是新冠病毒侵入人体的关键。
西湖大学特聘研究员陶亮进一步比喻:“我们可以把人的身体比喻成一个房屋。ACE2就像是房屋的‘门把手’。在新冠病毒侵入人体的过程中,S蛋白通过抓住‘门把手’,便打开了进入人体细胞的大门。”
最近美国得克萨斯大学奥斯汀分校的研究团队展示了新冠病毒的S蛋白全长结构。
然而,ACE2到底在细胞膜上是以什么状态存在?新冠病毒对比SARS病毒与ACE2结合有何异同?
要解答这些问题,仅解析“敌人”的相貌还远远不够。

聚焦——
看清“敌我”,百战不殆
要想百战不殆,知彼,也需知己。看清存在于人体内的ACE2的完整蛋白结构,就看清了自己。
获得ACE2的全长蛋白结构,因而也是研究团队攻坚的第一步。
ACE2难以在体外稳定获得。周强以及鄢仁鸿在大量的文献中发现,ACE2与肠道内的一个氨基酸转运蛋白B0AT1可以形成复合物。经试验,他们获取了ACE2与B0AT1优质稳定的复合物,从而取得了ACE2的全长蛋白结构。
基础科学的成果并非一蹴而就。过去两年,周强实验室一直在研究人源氨基酸转运蛋白,他们锁定了数种目标蛋白,ACE2就是其中一种。而后,新冠肺炎疫情爆发,周强团队迅速将ACE2研究工作的优先级提升,以最快速度取得研究成果,为后续药物设计和研发提供关键信息。
通过分析ACE2的全长蛋白结构,周强实验室发现ACE2以二聚体形式存在,同时具有开放和关闭两种构象变化,但两种构象均含有与新冠病毒的相互识别界面。
“总体而言,ACE2全长结构的解析,将有助于理解冠状病毒进入靶细胞的结构基础和功能特征,对发现和优化阻断进入细胞的抑制剂有重要作用”,清华大学全球健康与传染病研究中心主任张林琦教授说。

推进——
复原病毒“开门”一刻
有了ACE2全长蛋白结构,周强实验室进而解析了全长ACE2与新冠病毒S蛋白受体结合域的复合结构。
本端记者在周强实验室的电脑上,看见到了最新获取的复合结构界面图。随着鼠标的拖动,图片展示出不同角度的三维透视效果。
“它相当于全方位展示了新冠病毒S蛋白握住‘门把手’那一刻时,病毒和ACE2的状态。”周强说。
那么,这次解析出来的复合物结构上透露了什么?
周强实验室研究团队发现,新冠病毒的S蛋白看似一座桥横跨在ACE2表面,又像病毒的一只手,紧紧抓住ACE2。这一点与SARS病毒侵入的样子很相似。
而且,新冠病毒S蛋白的受体结合结构域与SARS病毒的序列也非常像,相似性达到82%。但进一步分析又发现,对比SARS与ACE2的相互作用,新冠病毒S蛋白与ACE2结合的氨基酸残基中,有一部分发生了较大改变。
“这也许可以解释为什么新冠病毒和SARS病毒与ACE2的结合能力不一样。这种结合能力可能影响了病毒的传染力。”不过,影响究竟是增强还是减弱,周强表示,还需要通过其他实验手段验证。

作用——
为药物设计提供有力帮助
科研要知其然,也要知其所以然。获取病毒“开门”一刻,并对此进行分析,将对防疫抗疫产生重要意义。
“知道锁孔长啥样,然后照这个配钥匙。不然就要用无数个钥匙去试哪个可以开门。” 一位网友曾如此评价这项研究的价值。
换言之,看清了“锁孔”,就可找到一个匹配的“盾牌”堵住它。人体的大门也就不会被病毒打开。
此前有研究显示:每个冠状病毒的S蛋白上,约有1300多个氨基酸。新冠病毒S蛋白上,有300多个氨基酸负责与ACE2相互作用。相当于这些氨基酸共同握着能够打开人体大门的钥匙。
有没有可能模拟一种蛋白,不是病毒,又能把受体先饱和住,从而阻拦病毒与受体的相互作用?有没有可能把受体与病毒结合的表面进行优化,并且把它转移到某个抗体的骨架上,从而设计出更加强有力的综合抗体,作为抑制病毒的手段?
“理解了新冠病毒侵染细胞的机理,就是希望为药物设计提供有力的帮助。”周强认为,在解析全长ACE2与新冠病毒S蛋白受体结合域的复合结构的基础上,许多进一步的探索都将有了一些方向。
原标题:西湖大学研究团队获重大突破:深度解密新冠病毒侵染人体一刻
【免责声明】上游新闻客户端未标有“来源:上游新闻-重庆晨报”或“上游新闻LOGO、水印的文字、图片、音频视频等稿件均为转载稿。如转载稿涉及版权等问题,请与上游新闻联系。