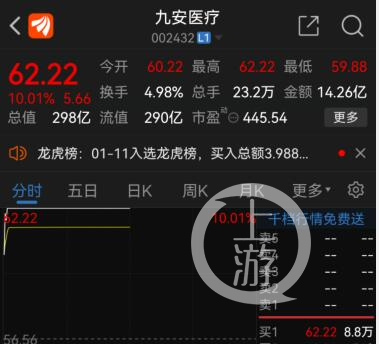
1月12日,九安医疗再度封板,这是该股票自2021年11月15日以来收获的第25个涨停,阶段涨幅超8倍。九安医疗凭啥这样牛?下一个会是谁?
与此同时,另一家公司东方生物(688298)也暴涨超14%,截至发稿报338.17元,涨14.63%。
此外,其他检测新冠公司如博拓生物、美康生物、天瑞仪器、亚辉龙、九强生物等继续走高。
新冠自测试剂盒引爆行情
九安医疗本轮大涨始于去年11月的一则公告。
2021年11月7日晚间,九安医疗披露《关于子公司新冠抗原家用自测OTC试剂盒获得美国FDA EUA授权的公告》。
公告显示:九安医疗于北京时间2021年11月6日凌晨获悉,经美国食品药品监督管理局(FDA)授权,公司美国子公司iHealth的新型冠状病毒(SARS-CoV-2)抗原家用自测OTC试剂盒(胶体金免疫层析法)获得应急使用授权(EUA)。该产品获得美国应急使用授权(EUA)后,可在美国公共卫生健康应急期间,在美国和认可美国EUA的国家/地区销售。

截自九安医疗2021年11月7日公告
在这份公告披露之前,九安医疗股价处在长达一年多的震荡下行之中,并刚刚创下多年新低。
但在随后的两个月内,九安医疗通过互动平台、公司公告、媒体采访等多种渠道发布新冠自测试剂盒的最新进展。例如:
2021年12月20日,九安医疗在互动平台回复投资者提问时表示:“从原理上讲,我们相信公司的抗原检测产品可以检测到奥密克戎变异毒株。目前公司正在等待毒株的到来,实验室已做好了准备,一旦取得毒株,我们会尽快进行试验。”
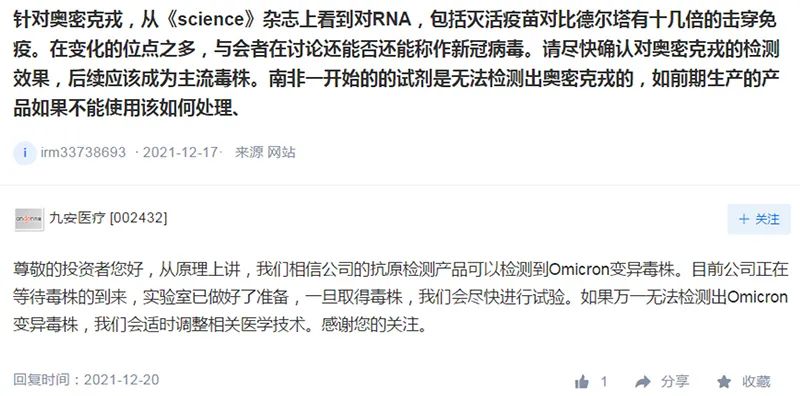
截自深交所互动平台
2022年1月7日晚,九安医疗披露公告,表示公司收到了美国FDA安排的美国国立卫生研究院的RADx项目就iHealth新冠抗原家用自测OTC试剂盒(iHealth–Covid-19 Antigen Rapid Test)针对奥密克戎变异病毒的测试性能实验报告。
报告显示:iHealth–Covid-19 Antigen Rapid Test在实验中100%的检测出了最大CT值为21.59(n=5)的奥密克戎活性病毒样本。

截自九安医疗2022年1月7日公告
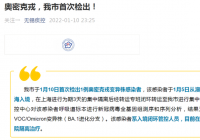
2022年1月10日,九安医疗董秘在接受媒体采访时表示:“为了能在天津实现核酸测试+家庭自测,高效阻断奥密克戎传播,我们提出以下公共卫生防疫建议,……,以上建议希望能得到天津疫情防控指挥部领导的考虑,并能将九安医疗‘iHealth 新冠自测盒’通过天津市药品监督管理局应急批准,尽快投入天津阻断奥密克戎传播防控第一线。”
“散户大本营”交易九安医疗踊跃
在交易所公布的龙虎榜(交易公开信息)上看,个人投资者构成推动九安医疗股价连续异动的重要力量。
过去两个月内,九安医疗陆续被公布了超过20张龙虎榜,东方财富证券旗下多家拉萨地区营业部成为上榜主力。
以今年首张龙虎榜为例。2022年1月4日,九安医疗因日内股价振幅超过15%而被公布龙虎榜,买卖前五共计10个席位中,东方财富证券占据7席,且单个席位在买卖两侧的上榜金额均超过5000万元。
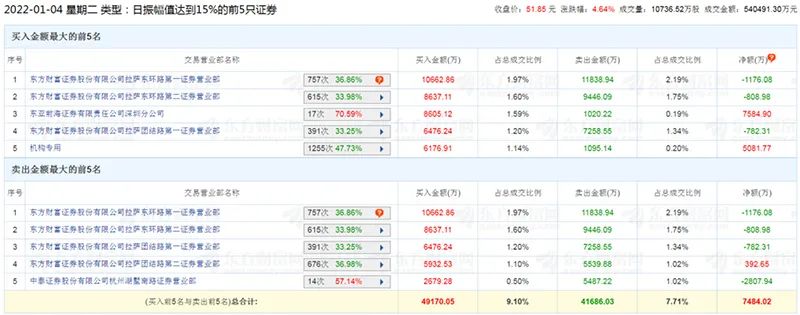
九安医疗2022年1月4日龙虎榜
据了解,作为互联网券商龙头,东方财富证券将投资者网上开立的账户归拢至部分拉萨地区营业部。这因为如此,上述东方财富证券拉萨营业部被市场称为“散户大本营”,其上榜数据可用来观察个人投资者的交易活跃度。
美国新冠自测计划渐明,百亿美元市场空间打开
据路透社报道,Omicron(奥密克戎)在美国愈演愈烈,单日新增确诊的感染者人数,又一次创新高。 美国在当地时间1月10日通报至少135万例确诊病例,打破单日确诊病例数的纪录。
美国总统拜登曾于2021年12月21日宣布,从2022年1月份开始,向美国民众免费发放5亿份家用快速检测试剂盒,用于对抗疫情。据新华社报道,面对新增病例飙升局面,美国新冠病毒检测能力捉襟见肘。美国政府1月4日宣布,即将签署5亿份新冠病毒快速检测盒采购合同。
据CNBC最新报道,该计划将于1月15日正式实施,开始由保险公司承保,白宫政府已于1月10日(周一)宣布了该政策。
目前,美国人口为3.3亿。若按照保险公司每月支付8次计算,美国政府免费向民众发放试剂盒的每月需要量,约为26亿份快速检测试剂盒,就意味着130亿元美金订单。
截至目前,只有九安医疗(002432)、东方生物(688298)和艾康生物3家企业。
2021年11月7日晚,九安医疗公告称,九安医疗美国子公司iHealth Labs Inc的新型冠状病毒(SARS-CoV-2)抗原家用自测OTC试剂盒(胶体金免疫层析法)获得应急使用授权(EUA)。该产品获得美国应急使用授权(EUA)后,可在美国公共卫生健康应急期间,在美国和认可美国EUA的国家/地区销售。
东方生物迅速获得出口白名单
根据公司新闻报道,在获得 FDA EUA 授权后,浙江省商务厅、中国医保商会加班加点审核,并在美国 FDA 中国办公室和美国大使馆积极协助和支持下,使得东方基因的新冠抗原诊断试剂第二天就进入商务部出口白名单目录(出口单位为东方基因,持证公司为西门子),创下了进入白名单最快的记录。
据中国海关统计数据,2020年全国出口新冠检测试剂收入预计50亿美元左右,东方生物新冠检测试剂(抗体+抗原为主)实现收入 29.6 亿人民币,约占全国出口总收入的 9.2%。2021 年上半年全国新冠检测试剂(包括新冠抗原/核酸/抗体检测试剂)出口额449亿人民,东方生物新冠检测试剂(抗原为主)出口收入近62亿人民币,占全国出口总收入的13.8%。此次国内企业打开美国抗原检测市场后,东方生物有望占据一席之地,2021H1 产能水平约为 500万人份/日,后续计划可能将产能扩充至800~1000万人份/日,并以销定产实时调整产能。

公司的新冠抗原居家自测试剂打开美国市场,抗疫龙头综合竞争力不断强化。作为少数抓住新冠抗原检测机遇的 IVD企业,公司管理层展现了前瞻眼光和优秀执行力,并且凸显了优异的产品技术和品质、快速扩产制造能力以及海外营销优势。
2021年12月30日,东方生物公告称,公司的客户SIEMENS HEALTHINEERS(简称“西门子医疗”)的“CLINITEST”新型冠状病毒抗原自测试剂于北京时间2021年12月30日取得FDA EUA紧急使用授权,公司本次作为西门子医疗该抗原自测产品的指定授权供应商,该EUA紧急使用授权的详细信息也已于同日在美国食品药品监督管理局(FDA)官方网站公示。该产品获得美国紧急使用授权(EUA)后,可在美国公共卫生健康应急期间,在美国和认可美国EUA的国家/地区销售。
这些公司有望加入
值得注意的是,包括美康生物(300439)、博拓生物(688767)、万泰生物(603392)和万浮生物(300482)等公司快速检测试剂产品,也正在申请美国的FDA认证。
美康生物表示,公司正积极筹备向美国FDA申请相关新冠产品的认证;博拓生物表示,公司新冠抗原自测产品美国FDA认证申请工作正在推进中;
万浮生物表示,公司时刻关注全球疫情动态,推动新冠检测产品的海外注册。新冠抗原产品在美国FDA的注册,公司也在有序推进中;
万泰生物表示,公司暂无新冠检测试剂(抗原类)在美国销售,新冠检测试剂(抗原类)正在申请美国FDA注册许可。
【免责声明】上游新闻客户端未标有“来源:上游新闻”或“上游新闻LOGO、水印的文字、图片、音频视”等稿件均为转载稿。如转载稿涉及版权等问题,请联系上游。